子科生物报道:2021年12月20号,国际分子医学领域重要期刊《EMBO Molecular Medicine》在线发表了中国科学院动物研究所朱顺义研究员团队在肽类抗生素领域的最新科学发现(Adaptively Evolved Human Oral Actinomyces-Sourced Defensins Show Therapeutic Potential)。该发现首次报道了人类口腔放线菌为肽类抗生素的新来源。
由于传统抗生素的广泛使用,特别是滥用,导致了细菌耐药性的不断出现。更为严重的是,细菌耐药性的传播速度已明显快于新抗生素的研发速度。因此,人类亟需加快寻找新的自然资源用以发展具有独特化学结构和作用模式的新型抗生素以延缓细菌耐药性的发生。
多细胞真核生物的抗微生物肽(也称肽类抗生素。如防御素)是一类天然免疫的效应分子,构成抵御微生物感染的第一道防线。自发现以来它们一直被认为有望成为传统抗生素的替代品。可是,尽管长达数十年的研究,很少多细胞真核生物的抗微生物肽达到了治疗系统性感染的临床应用阶段。究其原因,两个内在的因素是关键:(1)它们中的大多数承担对身体局部环境的保护作用而不是被输送到体循环,结果导致全身给药时血清稳定性下降;(2)它们的免疫调节功能会因为全身给药而产生广泛的毒性。为此,该团队提出原核生物的抗微生物肽可能更具开发前景。
通过对微生物基因组数据库的搜索,研究团队发现了一类限制性分布于放线菌和粘细菌基因组的类真核生物防御素的同源基因。不同于动物和真菌防御素,定植于人类口腔以及反刍动物的瘤胃和牙菌斑的放线菌来源的防御素呈现明显的自然选择特征,且所有的选择位点均定位于分子表面,提示它们在应对复杂的多物种细菌群落中的适应性作用以及自然选择对其抗菌分子表面的优化策略。
研究发现,化学合成的人类口腔放线菌来源的防御素AMSIN与真核生物防御素在空间结构上高度保守。AMSIN对口腔链球菌、葡萄球菌的临床分离株以及肺炎链球菌等革兰氏阳性细菌均表现出强大的抗菌活性,且能与两类人口腔唾液抗菌因子协同作用。AMSIN特异性抑制敏感细菌肽聚糖的生物合成而引发细菌死亡,该机制通常被认为可以延缓细菌抗药性的发展。AMSIN对人类和哺乳动物心脏及中枢神经系统的离子通道(如Nav1.5, Kv1.5, Kv4.3 和 hERG)以及两株人类细胞系(HEK293和HL60)缺乏毒性。它具有高度的人和哺乳动物血清稳定性、低的免疫调节活性且没有明显的免疫原性。在肺炎链球菌诱发的实验性小鼠肺炎模型以及耐甲氧西林金黄色葡萄球菌诱发的腹膜炎感染模型中,AMSIN均表现出良好的治疗效果。
该研究工作在EMBO Molecular Medicine期刊专题配发的《新闻与观点》进行了评论(Mining the bacterial genome to discover new antimicrobial molecules)。认为该工作的科学意义在于:(1)首次发现适应性进化的口腔放线菌的防御素具有药物开发潜能;(2)公共可获取的微生物基因组资源为人类研发新一代抗生素带来了希望;(3)进一步加大对复杂环境中的放线菌以及粘细菌的基因组测序可能加快新型肽类药物的发现进程;(4)为研究口腔细菌与人类之间的关系提供了新的线索。
中国科学院动物研究所朱顺义研究员为本文的第一和通讯作者。日本北陆先端科学技术大学院大学(JAIST)的Shinya Ohki教授、比利时鲁汶大学的Jan Tytgat教授以及国家纳米科学中心的李平博士参加了此项研究。该工作得到了国家自然科学基金的资助。
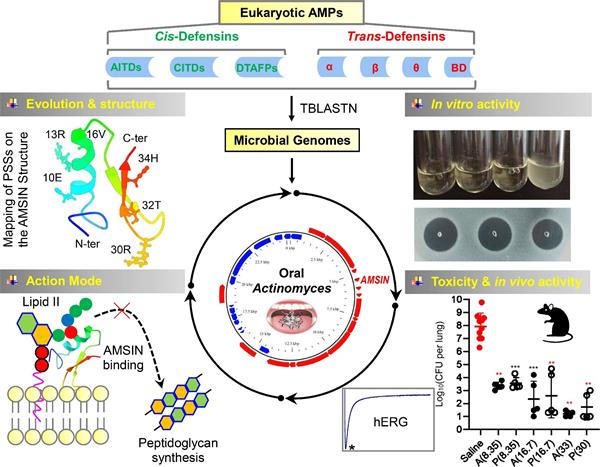
图1 细菌防御素:从基因发现到抗生素药物先导