子科生物报道:近日,厦大药学院吕忠显教授课题组与医学院王海滨教授课题组合作,揭示Menin蛋白和Shp2蛋白调控子宫内膜基质细胞蜕膜化的新机制,相关成果接连发表在Nature Communications和PloS Genetics期刊。
Menin的调控机制示意图
高度程序化的子宫内膜-蜕膜转化是哺乳动物早期妊娠过程中的一个关键事件,子宫内膜基质细胞经历复杂的分子重编程,受到来自胚胎、子宫内外的多种信号的精确调控,但目前对其中的调控和机制了解还远远不够。
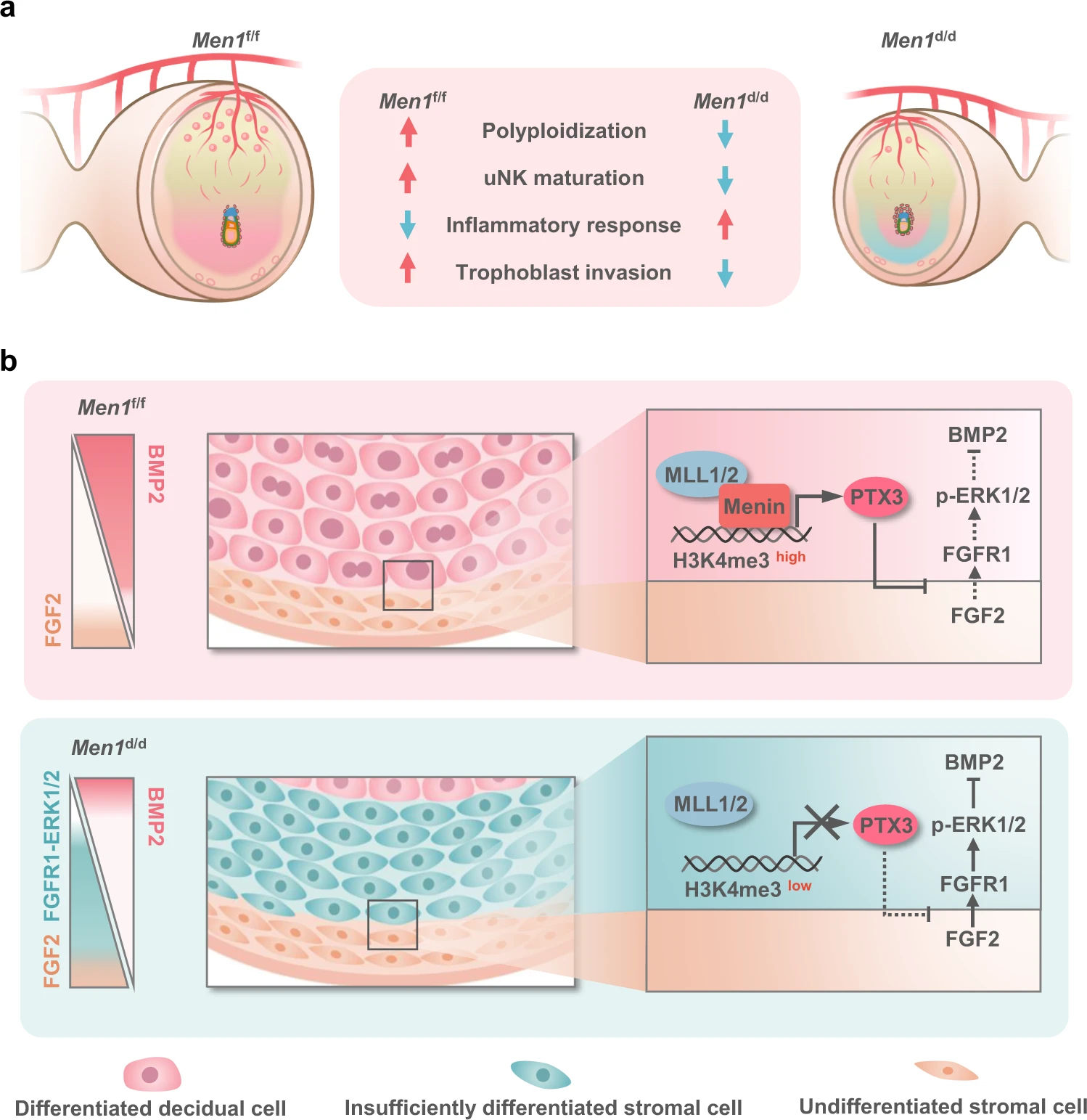
课题组通过合作研究发现,H3K4甲基转移酶复合体MLL1/2-COMPASS中的特异性亚基Menin能通过H3K4me3改变启动子附近的染色质状态,参与调控相关基因的转录激活。小鼠子宫特异性敲除Men1(编码Menin蛋白)导致雌性小鼠生育力显著降低,在妊娠中期出现胚胎的流产现象,原因是子宫内膜蜕膜发育的缺陷。分子机制研究证明Menin是平衡基质细胞增殖信号与分化信号的关键蛋白,Menin-H3K4me3调控下游靶基因PTX3表达,抑制来自未分化基质细胞层的FGF2,防止FGF2以旁分泌的形式激活次级蜕膜区中的ERK1/2,保证Bmp2在蜕膜分化区域的稳定表达。Menin在基质细胞的缺失导致FGF2-ERK1/2信号异常激活和Bmp2表达被抑制,从而导致基质细胞蜕膜发育分化不足。
这些发现揭示了一个新的调控蜕膜区域化发育特性的分子机制,为更好阐释胚胎植入和蜕膜发育稳态失衡诱发生殖障碍的分子机理提供了新思路,也为女性不孕的治疗提供了潜在治疗靶点。

相关成果2月22日在线发表在Nature子刊Nature Communications杂志,药学院2018级博士研究生刘梦莹和医学院邓文波教授为共同第一作者,通讯作者是医学院王海滨教授、药学院吕忠显教授和医学院孔双博副教授。
酪氨酸磷酸酶Shp2是功能广泛的信号蛋白,在多种组织中传导和整合多种信号。合作课题组2017年在PNAS发文揭示Shp2在妊娠早期随着胚胎的植入过程有一个动态的表达,在子宫内膜上皮细胞和基质细胞同时敲除Shp2基因,破坏了雌激素信号对孕激素受体的调控,阻止胚胎的附着。随后课题组在子宫内膜上皮细胞或基质细胞细胞单独敲除Shp2的基因,发现子宫内膜上皮细胞Shp2缺失不影响胚胎植入,而基质细胞缺失则延迟内膜基质细胞的蜕膜化,造成胚胎不能及时植入和植入后的流产。Shp2的这一功能在人子宫基质细胞上也得到证实,其蛋白的表达控制着蜕膜化的进程。机制研究表明,Shp2通过影响多种信号调控子宫基质细胞蜕膜化过程中的细胞周期变化和功能基因表达。

这些结果揭示了与Shp2蛋白相关的子宫基质细胞蜕膜化新的调控方式,于1月28日在线发表于PLoS Genetics期刊。药学院2013级博士研究生程江红、2017级硕士生梁佳和2015级硕士生李莹哲为共同第一作者。医学院王海滨教授、孔双博副教授和药学院吕忠显教授为本文通讯作者。