子科生物报道:2023年2月7日,北京大学药学院天然药物及仿生药物国家重点实验室王坚成教授团队和北京大学第三医院运动医学江东主任医师团队在国际学术期刊《Advanced Science》共同发表了题为“Nanomedicines Reprogram Synovial Macrophages by Scavenging Nitric Oxide and Silencing CA9 in Progressive Osteoarthritis”的研究工作。该研究首次证明骨关节炎(OA)患者和单碘乙酸诱导的骨关节炎模型小鼠的关节组织滑膜巨噬细胞中碳酸酐酶IX(CA9)表达显著增加,并提出了基于CA9和一氧化氮(NO)的双管齐下清除策略,成功构建了CA9 siRNA和NO清除剂共递送的“二合一”纳米药物,用于重编程滑膜巨噬细胞有效抑制OA进展。

骨关节炎(OA)是一种以炎症和软骨破坏为主要病理特征的慢性关节退行性疾病,被世界卫生组织(WHO)列为人类健康的“三大杀手”之一。目前已上市药物治疗OA仅能缓解疼痛症状,但无法有效阻止OA进展。尽管已有研究证据表明,OA进展与功能失调的滑膜巨噬细胞M1/M2表型失衡密切相关,可以通过调控M1/M2滑膜巨噬细胞进行OA治疗,但仍受限于M1/M2表型的复极化效率和严重炎症微环境,难以有效抑制OA进展。开发新的治疗靶点和策略重塑炎症微环境对于改善骨关节炎治疗效应具有重要意义。
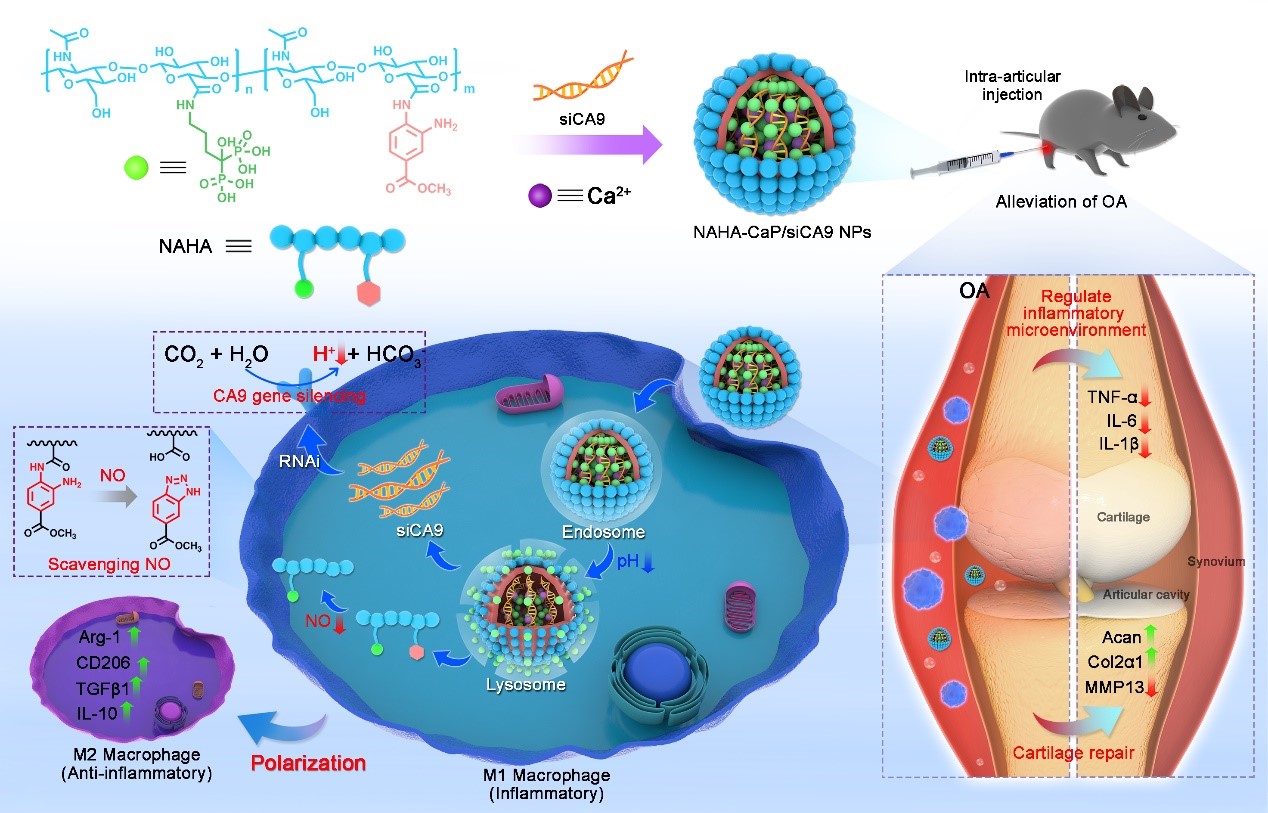
考虑到关节腔内滑膜炎症与OA的酸性微环境密切相关,正常滑液和关节炎滑液的pH值范围分别为7.4–7.8和6.6–7.2;M1巨噬细胞的炎症特性也受到酸性和缺氧环境代谢变化的影响。本研究团队提出重塑炎症微环境,有利于实现重编程M1/M2表型进而改善OA进程的新治疗策略。本研究首次证明OA患者和单碘乙酸诱导的OA模型小鼠的关节组织滑膜巨噬细胞中碳酸酐酶IX(CA9)表达显著增加,可调节滑膜巨噬细胞内外pH平衡,并促进缺氧和酸性微环境。此外,M1巨噬细胞产生的一氧化氮(NO)水平也比M2巨噬细胞高约30倍,然而,NO的合成抑制剂或清除剂的研究也仅限于类风湿关节炎和早期OA治疗。
在本研究中,以骨关节滑液天然成分透明质酸(HA)为骨架,设计并合成了一种接枝阿仑膦酸和邻苯二胺的新型糖基聚合物材料(NAHA),并利用磷酸钙复合物包裹siRNA形成内核的方式组装得到非阳离子型纳米粒(NAHA-CaP/siRNA)。利用siRNA对CA9基因沉默效应,协同邻苯二胺的NO清除能力改善骨关节炎的滑膜酸性微环境、NO高水平相关的炎症病理特征。实验结果表明这些纳米载药颗粒通过显著下调CA9 mRNA的表达水平(~90%),降低细胞内外NO浓度,从而促进M1巨噬细胞重新极化为M2表型,并抑制多种促炎细胞因子的产生,上调促软骨生成细胞因子和软骨基质相关基因表达,减少软骨细胞凋亡;并且在单碘乙酸诱导的早期和晚期OA小鼠模型、以及内侧半月板手术失稳诱导OA大鼠模型中有效缓解OA进展,具有相比临床药物地塞米松相当的抗炎作用,和更强的关节软骨保护和修复潜力。该研究利用CA9基因表达抑制和NO清除的双重效应策略重塑炎症微环境,显著改善OA进程,为治疗OA提供了一种创新的治疗策略,具有良好的临床转化应用前景。

左起:闫仪、卢安、窦赟