子科生物报道:G-蛋白偶联受体(G protein-coupled receptor,GPCR)是细胞表面受体家族中最大的一类,调控着人体各种生命活动且与疾病密切相关,有超过30%的药物作用于 GPCR。而B类GPCRs是一类重要的多肽激素受体,包括胰高血糖素受体(GCGR)、胰高血糖素样肽-1受体(GLP-1R)、葡萄糖依赖性胰岛素释放多肽受体(GIPR)和甲状旁腺激素受体1(PTH1R)等在内的共15个激素受体,它们主要通过调节多肽类激素的信号传导来调控多种生理功能,包括血糖调节、骨代谢、胃肠道功能、神经调节和生长调节等,并涉及许多疾病的发病机制,如糖尿病、骨质疏松症和癌症等,因此,B类GPCRs成为治疗肥胖、糖尿病和骨质疏松症、抑郁、心血管疾病、癌症等多种疾病的重要药物靶点。然而,由于B类GPCRs的复杂结构和信号传递机制,针对这些受体的药物开发,尤其是小分子激动剂药物一直面临挑战。虽然一些针对B类GPCRs的多肽药物已成功上市,包括用于治疗2型糖尿病药物GLP-1类似物以及骨质疏松症药物PTH和PTHrP类似物等,但是这类多肽类药物需要皮下注射,使用不便,费用昂贵,且伴有头痛、恶心等副作用。
与注射肽类药物不同,小分子药物可以开发成片剂,并具有更好的药物特性,因此,小分子激动剂药物研发在近年来受到科学家的广泛追捧。然而,针对B类GPCRs的小分子激动剂药物临床应用却一直没有突破。在这种背景下,中国科学院上海药物研究所徐华强/赵丽华研究团队系统地开展B类GPCRs的结构解析和分子机制研究,在过去十多年里,在B类GPCRs激动剂作用机制研究领域取得了一系列突破性进展。
研究团队早在2008年到2010年期间就解析了多个B类GPCRs的胞外结构域(ECD)晶体结构,阐述了内源性多肽与B类GPCRs的识别作用机制1-3。2016年,研究团队合作揭示 B 类 GPCRs 激活对 ECD 的需求不同的作用机制4,并阐述GLP-1R的ECD激活内在的激动作用机理,为 GLP-1R 及下游信号转导激活机制研究奠定基础5。2017年与王明伟团队合作在J Biol Chem以封面文章提出了B类GPCRs受体第六跨膜的构象发生改变从而产生自我激活效应的分子机制6。到2019年在全长B类GPCRs激活机制方面又取得突破性进展,研究团队与浙江大学张岩团队、上海药物所王明伟团队等多方合作在Science上首次报道了1型人源甲状旁腺激素受体(Parathyroid hormone type 1 receptor, PTH1R)与Gs蛋白复合物的三维结构,揭示了其长效激活状态下的分子动力学机制,为创制治疗骨质疏松症等疾病的新药奠定了坚实的基础7。2020年,研究团队与张岩团队合作在Molecular Cell揭示促肾上腺皮质激素释放因子受体的激活机制8;与王明伟/杨德华研究团队、张岩团队合作在Nature Communications首次揭示了GHRHR的配体识别、信号激活及疾病发生的分子机制,为相关新药的研发奠定了坚实的基础9。在Cell research上揭示 GLP-2R 独特的配体识别和受体激活机制,为小肠短小综合症(Short bowel syndrome, SBS)和克罗恩氏病(Crohn's disease)的药物研发提供重要的结构信息10。在Nature Communications报道了VIP1R与多肽配体PACAP27和Gs蛋白复合物的冷冻电镜结构11。在Cell research上首次解析了完全激动剂小分子化合物与GLP-1R复合物的冷冻电镜结构,阐述了小分子完全激动剂激活GLP-1R的分子机制12。2021年,研究团队与王明伟/杨德华研究团队合作在PNAS上揭示了PTH2R 的配体选择性及疾病发的分子机制13,在Elife揭示了 GIPR 的配体识别和信号转导的分子机制,为基于GIPR 药理学的2型糖尿病的药物发现提供了重要的结构信息14, 在Nature Communications上揭示了GLP-1R变构激动调节的分子机制15。在PNAS上阐述了B类GPCRs结构性信号偏向转导机制16。2022年,研究团队与王明伟/杨德华团队合作在Nature Communications系统阐明了GLP-1R/GCGR/GIPR双重和三重激动剂的配体识别和受体激活机制,在原子水平揭示了它们发挥多重药理效应的关键位点,为治疗2型糖尿病设计和开发更为有效的新型多重激动剂提供新思路17。研究团队合作解析B类GPCRs受体家族15个成员中最后一个受体,VIP2R的三维结构18。研究团队与山东大学于晓团队、浙江大学张岩团队合作在Nature Communications上揭示B类GPCRs的G蛋白选择性偶联激活机制19,与王明伟/杨德华研究团队合作在APS上进一步揭示甲状旁腺激素受体1的两个内源性多肽激素的分子识别和激活机制20。
2023年7月31日,在B类GPCRs小分子激动剂激活作用机制方面取得突破性进展,该研究团队在Nature杂志上以“快速通道”方式发表了最新研究成果“Conserved class B GPCR activation by a biased intracellular agonist”。团队发现了B类GPCRs的新型小分子激动剂结合口袋,由于该结合口袋在B类GPCRs中具有较高的保守性,并且能够激活多种受体,这为研发针对该口袋的小分子激动剂提供了新的可能性。因此,该药物口袋的发现为治疗糖尿病、肥胖、骨质疏松和其他涉及B类GPCRs的疾病的药物研发提供了新的方向和途径,为开发更具选择性和有效性的药物打开了新的视野。这种药物口袋的发现可以为未来的新药研发提供重要的基础和潜在机会(图1)。
通过冷冻电镜技术,研究团队获得了B类GPCRs中最重要的成员之一PTH1R与小分子激动剂PCO371的高分辨率结构,通过结构分析和功能实验发现B类GPCRs存在类似PCO371结合的保守的小分子结合口袋,揭示了PCO371的新型的结合模式,同时发现PCO37具有G蛋白信号通路偏向性激活作用,为B类GPCR的小分子药物设计和开发提供了新的见解和新的途径,通过针对这个保守的口袋进行药物研发,有可能开发比当前治疗方法更具选择性且副作用更少的药物。该研究发现的新型小分子激动剂结合口袋,揭示了B类GPCRs激活的独特机制,为创新疗法铺平了道路,该工作展示了对B类GPCRs的开创性研究及其作为药物靶点的巨大潜力。
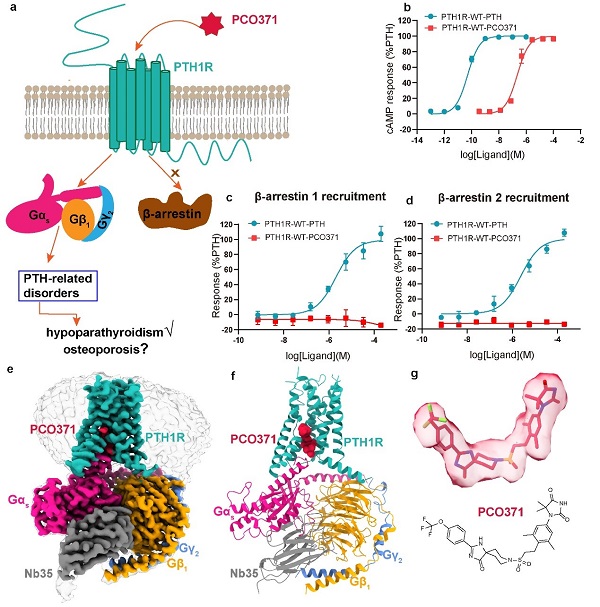
具体地说,PCO371结合在PTH1R与Gs蛋白的胞内界面上,与以前报道的所有GPCR中配体的结合位点完全不同。PCO371作为偏向激动剂,优先通过G蛋白触发信号传递,而非通过阻遏蛋白arrestin。这种偏向性激动剂有助于减少阻遏蛋白arrestin信号通路引起的副作用,提高药物的安全性和有效性(图2)。
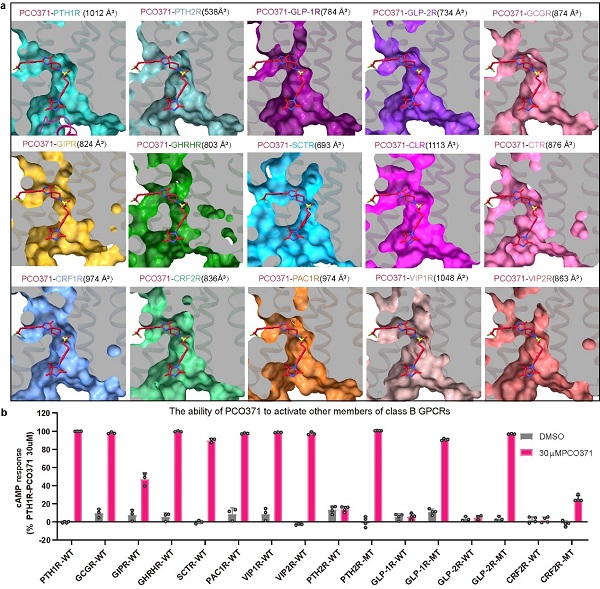
此外,研究团队通过结构分析和受体氨基酸序列比对发现,构成PCO371结合口袋的氨基酸残基在B类GPCRs中具有较高的保守性,使得PCO371能够激活B类GPCR中的8种受体,并且通过1个或2个点突变就可以使其他受体对PCO371产生反应(图3)。这些发现揭示了B类GPCRs小分子激动剂的独特结合位点,这个保守的结合口袋为开发新的治疗糖尿病、肥胖、骨质疏松和其他涉及B类GPCRs的疾病的口服药物提供了令人兴奋的机会,为针对2型糖尿病、肥胖症和骨质疏松症等疾病的不同类型B类GPCR小分子激动剂药物的设计和开发提供了新的思路和方法。
该研究由上海药物所徐华强研究员和赵丽华研究员领导的B类GPCRs研究小组成员通力合作完成。上海药物所赵丽华研究员、博士研究生何倩以及高峰电镜中心执行主任袁青宁为该论文的共同第一作者。上海药物所徐华强研究员、赵丽华研究员为论文的共同通讯作者。参与本次研究的还有上海药物所硕士研究生顾奕敏、博士研究生何欣恒、单虹博士、李俊睿博士、王凯副研究员、硕士研究生李阳,高峰电镜中心工作人员胡雯和吴凯以及沈建华研究员。本研究冷冻电镜数据在上海药物所高峰电镜中心收集,该项研究工作得到了国家自然科学基金委员会、国家重点研发计划、上海市科学技术委员会、中国科学院青年创新促进会、中科院战略性先导科技专项(B类)和原创新药研究重点实验室等项目资助。
论文链接:https://www.nature.com/articles/s41586-023-06467-w
图1右下角的小分子、受体和G蛋白复合物的三维结构是本研究中报道的PCO371-PTH1R-Gs复合物结构,呈现的是一种新型小分子结合口袋,气球代表B类GPCRs家族的15个成员,本研究中发现的新型小分子结合口袋的主要氨基酸序列在这15个受体中非常保守,宇航员带着这15个气球遨游在广阔的太空,并开启了对这个新型口袋的小分子药物研究新时代,未来针对这15个受体靶标的小分子药物研发将是科学家们探索的新领域,并且这个领域的未来发展将会是星辰大海。本研究揭示了B类GPCRs 15个受体中一个保守且可供药物作用的口袋,这可能带来用于治疗各种疾病的口服小分子药物的开发。
图2 PCO371偏向激活G蛋白信号通路,但不激活阻遏蛋白arrestin信号通路;PCO371-PTH1R-Gs复合物冷冻电镜高分辨结构以及呈现的新型配体结合口袋
图3 在B类GPCRs中普遍存在保守的类似PCO371的结合口袋