|
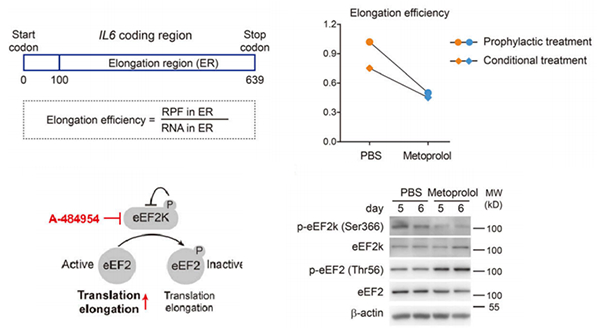
图 美托洛尔抑制CRS发生中的IL-6蛋白质翻译
在国家自然科学基金项目(批准号:31725010)等资助下,清华大学胡小玉团队和中国人民解放军总医院韩为东教授团队合作,在细胞因子释放综合征的治疗策略研究领域取得新进展。研究成果以“IL-6蛋白翻译是人类细胞因子释放综合征治疗靶点(IL-6 translation is a therapeutic target of human cytokine release syndrome)”为题,于2023年8月16日在线发表于《实验医学杂志》(The Journal of Experimental Medicine)。论文链接:https://doi.org/10.1084/jem.20230577。
CAR T细胞免疫疗法(Chimeric antigen receptor T-cell immunotherapy)在治疗血液系统的恶性肿瘤方面已经取得了非常显著的成效,但往往伴随着以细胞因子释放综合征(Cytokine release syndrome,CRS)为代表的严重副作用。CRS发生的标志之一是由免疫细胞过度活化而引起的细胞因子水平激增,其中单核细胞和巨噬细胞被认为是CRS中关键性细胞因子IL-6的主要来源。由于CRS过程中单核细胞和巨噬细胞异常活化的分子机制尚未阐释清楚,目前常用的CRS治疗药物多为依据既往临床经验的选择性用药,如通过抑制促炎因子转录或直接拮抗关键效应细胞因子活性产生抗炎作用等。而细胞因子蛋白质的翻译尚很少被作为潜在治疗靶点深入研究。
胡小玉课题组发现,治疗心血管疾病的常见药物美托洛尔可对CAR T细胞免疫疗法激发的IL-6产生抑制作用,该药物通过抑制蛋白质翻译而不是既往被广泛研究的mRNA转录水平。通过核糖体图谱,研究团队对CRS发生中人原代单核细胞和巨噬细胞的翻译组进行了描绘,结合一系列的体外实验,发现美托洛尔能够通过加强真核翻译延伸因子eEF2K-eEF2信号轴所介导的分子制动来抑制IL-6的翻译延伸效率,从而减少IL-6蛋白质的产生(图)。进一步,临床试验的结果提示美托洛尔干预疗法一方面在患者中具有良好的安全性,不损伤患者的心血管功能和CAR T细胞疗法的抗肿瘤效果;另一方面能够显著缓解轻症CRS,并减少重症CRS治疗中抗体类与激素类药物的使用,也为联合治疗重症CRS提供了早期的提示性医学证据。
该项研究揭示了美托洛尔缓解CAR T细胞疗法引发的CRS的细胞和分子机制,为研发更为精准的抗炎治疗药物提供了新思路。