自然杀伤(Natural killer,NK)细胞是机体免疫监视的主要效应细胞,可直接杀伤肿瘤细胞。以NK细胞为基础的靶向免疫疗法,具有直接杀伤肿瘤、毒副作用小以及来源广泛便于制备的优势,成为肿瘤免疫治疗的新势力。但如何促进NK细胞的活化以及提高NK细胞在体内的持久性是临床上亟待解决的问题。
2023年9月13日,上海交通大学药学院邓刘福团队在Cell Reports杂志发表了以“STING signaling promotes NK cell antitumor immunity and maintains a reservoir of TCF-1+ NK cells”为题的研究成果,该研究论述了肿瘤来源的cGAMP可通过调控NK细胞内源性STING通路影响抗肿瘤效应,揭示了NK细胞内源性STING通路维持瘤内TCF-1+ NK细胞亚群的新作用,拓展了STING激动剂在增强NK细胞抗肿瘤免疫疗法中的应用前景。

邓刘福研究团队致力于提高肿瘤内效应细胞免疫应答持久性的调节机制研究,并在T细胞干性维持领域取得了系列成果。研究团队近年先后揭示了CD8+ T细胞内源性DNA感受通路(Science Translational Medicine,2020)和性激素识别通路(Immunity,2022)在调节自身干性维持和效应功能方面的调节机理,为提升临床T细胞免疫疗法提供了新思路。作为肿瘤天然杀伤性细胞,NK细胞在肿瘤内如何实现自我维持尚不清楚,揭示NK细胞特征规律将为临床NK细胞疗法带来新突破。
研究人员在临床肿瘤样本分析时发现,肿瘤患者的外周血NK细胞中STING表达水平相比健康人显著下调;转移灶相比于原发灶中NK细胞中STING水平明显较低。这些结果激发了研究人员对NK细胞内源性STING通路意义的思考。进一步通过小鼠模型发现NK细胞特异敲除STING可明显增加肿瘤转移、促进肿瘤生长。这证实内源性STING通路对NK细胞介导的抗肿瘤效应至关重要。而与之相反的是,NK细胞特异敲除cGAS并不影响NK细胞抗肿瘤功能,肿瘤细胞mtDNA和cGAS才是NK细胞STING活化的关键,这也揭示了一种cGAS-STING通路跨细胞调控NK细胞的新模式。
该研究进一步分析NK功能和亚群发现缺失STING导致肿瘤浸润NK细胞杀伤功能受损,未成熟TCF-1+ NK细胞比例下降。同时,STING在人和小鼠未成熟NK细胞亚群中表达较高,这与TCF-1在NK细胞亚群中表达谱相似,这意味着TCF-1+ NK细胞亚群对STING活化可能具有更强的反应性。人的样本也验证了使用STING激动剂可诱导人外周血TCF-1+ NK细胞扩增,功能增强。提示STING激动剂处理可促进NK细胞反应的持久性,这为增强临床NK细胞免疫疗法的治疗效果提供了新策略。
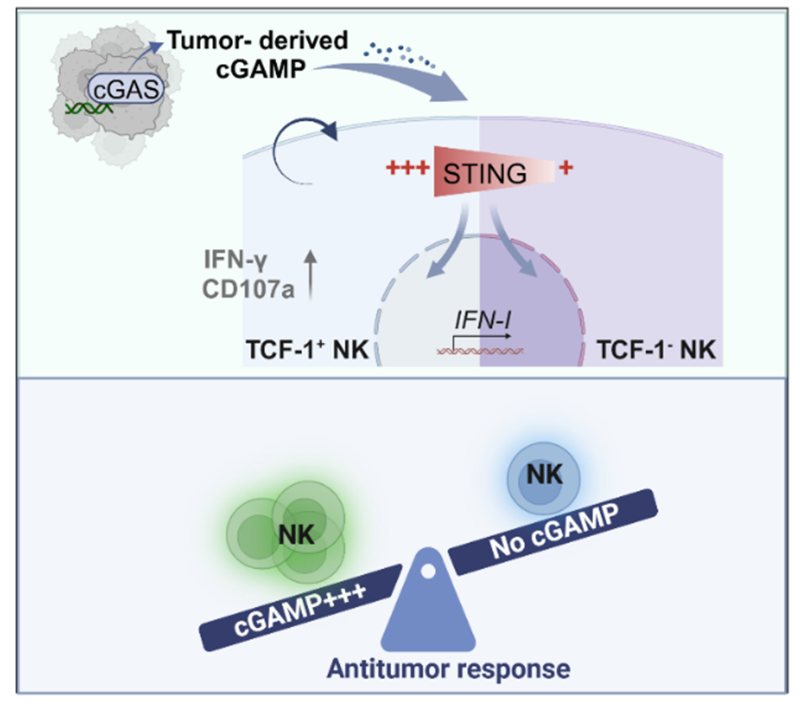
研究模式图
上海交通大学药学院邓刘福教授为该论文的通讯作者,上海交通大学药学院助理研究员路璐和博士后杨超为该论文的共同第一作者。该研究得到了上海交通大学附属仁济医院狄文教授、上海交通大学药学院张翱教授及上海交通大学医学院郑俊克研究员的大力支持。