子科生物报道:
2023年11月24日,生物治疗全国重点实验室钮大文教授团队在Science发表了题为“Palladium catalysis enables cross-coupling–like SN2-glycosylation of phenols”的研究文章。研究团队开发了一种新的激活糖基供体的模式,实现了钯催化促成SN2糖基偶联反应。

我院生物治疗国重博士生邓莉凡、核医学临床研究室王颖伟副研究员为文章共同第一作者,钮大文教授为通讯作者;我院为第一作者和通讯作者单位。
糖基化是药物开发中的常用工具。糖单元的引入往往可改变目标分子的水溶性、靶向性、代谢稳定性等性质。然而,将糖单元引入目标分子的化学方法却仍然面临诸多挑战。例如,大多数糖基化反应经历氧鎓中间体或其等价物,机理往往在SN1与SN2两极间摇摆,受温度、底物反应性、添加剂等多种因素影响,造成反应的立体选择性不易预测。此外,若糖基化反应需使用敏感试剂或不稳定底物,也会带来诸多操作不便。
钯催化的交叉偶联具有很高的鲁棒性,已成为有机合成中不可或缺的工具。研究团队提出,若糖基化反应可以与钯催化交叉偶联反应一样模块化,则糖类化合物的合成将得到极大简化,其下游功能则可得到更多研究。然而,钯催化通常在sp2杂化的碳中心方面有效,而糖苷键大多是sp3杂化的C-O键。
研究团队开发了一种新的激活糖基供体的模式。研究团队使用含有芳基碘化物的糖基硫化物作为供体,利用Pd(0)介导的氧化加成启动,关键的Pd(II)氧化加成中间体从芳基化试剂(C sp2亲电体)转变为糖基化试剂(C sp3亲电体)。这种方法继承了交叉偶联反应的许多优点,包括操作简单和官能团耐受性强;同时保留了SN2 机制,这也是反应产生高立体选择性的根本原因。关键中间体的单晶结构表明硫原子与钯中心的配位使C-S极化,促使其对苯酚化合物的进攻具有足够的亲电性。
该研究工作得到了国家自然基金委优青项目和创新群体项目、我院1?3?5计划项目、科研院创新领军人才项目的支持;部分实验分析测试部分在四川大学分析测试中心帮助下完成。
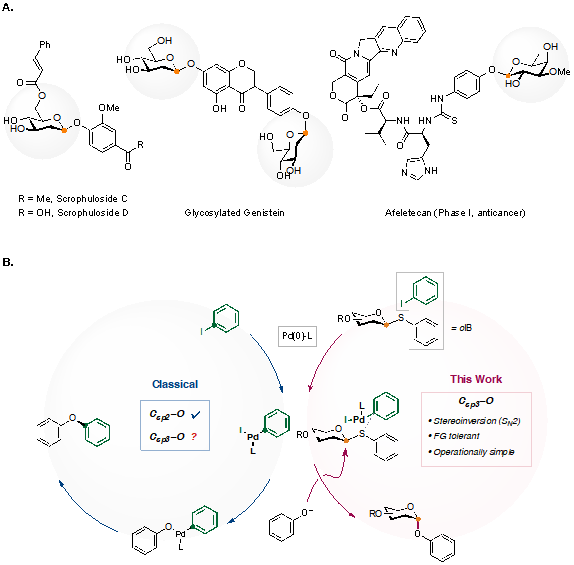
图. A) 药物和天然产物中的糖基化苯酚。B) 反应设计。