在当今社会,随着人口老龄化的加剧,痴呆症已成为全球性的健康挑战,目前全球约有5000万人患有痴呆症,预计到2050年,这一数字将增至1.52亿;其中血管性痴呆(VaD)作为仅次于阿尔茨海默病的第二大痴呆类型,占所有痴呆病例的约10%~20%,且常与阿尔茨海默病共存,形成所谓的“混合型痴呆”。然而,与阿尔茨海默病相比,血管性痴呆的研究和治疗进展相对滞后,目前尚无有效的药物疗法能促进血管性痴呆患者的康复,这种疾病的一个关键问题在于,大脑的损伤区域会随着时间的推移从最初的区域扩大从而导致患者的病情不断恶化。
近日,一篇发表在国际杂志Cell上题为“Deconstructing the Intercellular Interactome in Vascular Dementia with Focal Ischemia for Therapeutic Applications”的研究报告中,来自美国加州大学洛杉矶分校等机构的科学家们就通过研究在血管性痴呆症中发现了一种关键的大脑修复机制,有望作为一种新型治疗靶点。文章中,研究人员结合实验室和人类数据精准锁定了一条关键的信号通路,有望为这种被低估的痴呆形式带来首个有效的治疗方法。
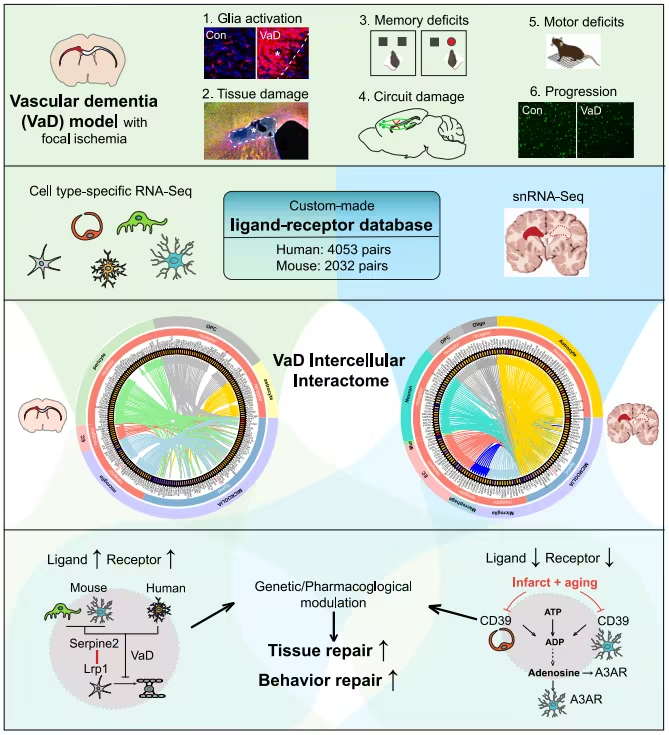
研究人员通过构建血管性痴呆小鼠模型,并结合转录组学和功能分析深入探究了病变部位的细胞间相互作用;他们将小鼠的细胞类型特异性血管性痴呆转录组与人类血管性痴呆单核RNA测序(snRNA-seq)数据相结合,并利用一个定制的配体-受体数据库(包含4053对人类和2032对小鼠的配对信息)在两种物种中识别出保守的失调细胞间通路,结果发现,在血管性痴呆中,两个细胞间信号系统(Serpine2-Lrp1和CD39-A3AR)会遭到破坏;Serpine2表达的减少能增强少突胶质细胞祖细胞(OPC)的分化并促进修复,而一种目前正处于银屑病临床试验中的A3AR特异性激动剂则能在血管性痴呆模型中恢复组织完整性和行为功能。
这项研究中,研究人员试图揭示大脑中这些损伤扩大区域究竟发生了什么变化,他们识别出在痴呆病变周围大脑细胞中相互通讯的所有分子,并确定了与正常大脑相比,在疾病中异常上调或下调的分子。通过在血管性痴呆的实验室模型和人类大脑中进行这一操作,研究人员就能精准识别出血管性痴呆中的“相互作用组”,即所有在受累细胞中信号传递或相互作用的分子。