子科生物报道:多形性胶质母细胞瘤(Glioblastoma multiforme,GBM)是一种恶性程度极高的脑部肿瘤。在正常生理条件下,GBM利用葡萄糖作为主要能量物质来源支持肿瘤细胞的快速增殖,此外,其它营养物质,如果糖、氨基酸和脂肪酸等,也可作为GBM的能量来源。流行病学研究表明果糖的过量摄取与肿瘤恶性进展密切相关。在哺乳动物细胞中,果糖代谢通路与葡萄糖代谢通路的起始阶段不同, GLUT5(由SLC2A5基因编码)负责把果糖转运进入细胞,在细胞中果糖被ketohexokinase磷酸化转化成1-磷酸果糖,随后 aldolase B将一分子1-磷酸果糖裂解为一分子甘油醛和一分子磷酸二羟丙酮,两者分别通过被triokinase磷酸化和异构化转化为3-磷酸甘油醛,进入糖酵解代谢途径。
在哺乳动物中,整合应激反应(Integrate Stress Response,ISR)可分为以下四种:内质网应激、氨基酸缺乏应激、病毒感染应激和血红素缺陷应激,对应激活以下四种蛋白激酶:PERK、GCN2、PKR和HRI。已有的研究表明这四种蛋白激酶可通过磷酸化蛋白翻译起始因子eIF2α选择性激活转录因子ATF4的翻译,随后ATF4激活其下游靶基因的表达完成细胞应激反应程序。
2022年10月16日,中国科学院生物物理研究所李新建研究团队在《Nature Communications》杂志上在线发表了题为"ATF4-dependent fructolysis fuels growth of glioblastoma multiforme"(https://doi.org/10.1038/s41467-022-33859-9)的研究论文。该研究揭示了GBM在葡萄糖缺乏条件下激活细胞ISR,通过针对ATF4染色质免疫共沉淀的高通量测序(ATF4 ChIP-Seq),研究人员发现ATF4能够结合在果糖代谢通路中的两个关键蛋白(GLUT5和ALDOB)编码基因的启动子区域并激活这两个蛋白的表达,通过基因编辑破坏SLC2A5和ALDOB启动子区域与ATF4结合的DNA序列能有效抑制ISR诱导的果糖代谢。进一步的功能研究结果发现从基因水平以及小分子抑制剂水平阻断ISR诱导的果糖代谢能够显著抑制GBM以果糖(非葡萄糖)为供能物质条件下的细胞增殖和克隆形成能力。并且,在裸鼠移植瘤模型中,研究人员发现GBM组织中广泛存在着由葡萄糖缺乏导致的ISR, 阻断ISR诱导的果糖代谢能有效延缓GBM的进展。以上证据提示果糖是GBM在葡萄糖缺乏条件下的替代供能营养物质,因此,GBM病人应警惕高果糖饮食,设计小分子药物靶向果糖代谢是潜在的GBM治疗手段。
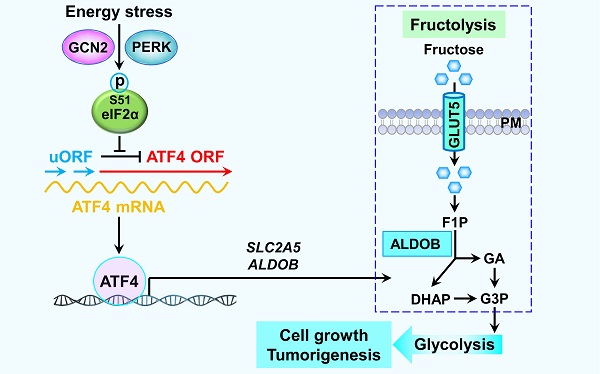
图. ATF4介导的果糖代谢促进胶质瘤的恶性进展。在能量应激(葡萄糖缺乏)条件下蛋白激酶GCN2和PERK通过磷酸化蛋白翻译起始因子eIF2α选择性激活转录因子ATF4的翻译,ATF4结合在果糖代谢通路中的两个关键基因SLC2A5和ALDOB的启动子区域并激活这两个基因的表达诱导的果糖代谢,为葡萄糖缺乏的GBM细胞提供能量来源并维持肿瘤恶性进展。
中国科学院生物物理研究所博士后陈超、张振兴为该论文的共同第一作者,中国科学院生物物理研究所李新建研究员为该论文的通讯作者。该研究得到了国家自然科学基金委、中国科学院和国家重点研发计划的经费支持。