子科生物报道:生物大分子凝聚体(Biomolecular condensates)是细胞内生物大分子(如蛋白质、核酸等)通过相分离(phase separation)形成的无膜细胞器,在细胞生命活动中起着至关重要的作用。过去十多年,生物大分子相分离的研究主要集中于动物和酵母体系,植物相分离蛋白的研究起步较晚,我们对具有潜在相分离能力的蛋白知之甚少。
蛋白的固有无序区(Intrinsically disordered region, IDR)又被称为低复杂度结构域(low complexity domain, LCD),通常富含特定的氨基酸残基,例如极性、芳香族和/或带电氨基酸,具有高度的构象灵活性,易于提供分子间/分子内多价的弱相互作用,是驱动蛋白相分离的重要因素。小分子化合物b-isox(biotinylated isoxazole)可以在低温下形成微晶体,促使LCD蛋白在其表面组装,从而特异富集这些蛋白。
清华大学生命学院方晓峰助理教授和邓海腾教授研究组合作,首先从拟南芥的幼苗和花组织中的细胞裂解液中鉴定到985个具有相分离潜力的蛋白,命名为ProX(Proteins enriched by b-isox)(图1A和B)。ProX列表几乎囊括了大部分目前植物中已被报道可以相分离的蛋白。为了高效的验证候选蛋白的相分离能力,研究团队利用酵母系统异源表达ProX中70个RBPs(RNA-binding protein)蛋白,其中67%都可以形成明显的凝聚体,其余的RBPs在热激胁迫下也能形成凝聚体。说明该研究建立的方法能够高效地鉴定和验证候选的相分离蛋白。
该研究进一步鉴定了拟南芥在不同胁迫处理条件下的相分离蛋白,包括渗透胁迫(250 mM山梨糖醇)、盐胁迫(150 mM NaCl)、热胁迫(37°C)和氧化胁迫(10 mM H2O2)的ProX。结果显示,大约25%的蛋白为各种胁迫条件所特异富集的(图1C)。
除了拟南芥,该研究还鉴定了其它具有代表性的7个物种中的相分离蛋白(图1D)。这一方面将为研究这些物种中相分离的功能研究提供资源,另一方面有助于从进化角度理解相分离的生物学的意义。这些物种的ProXs多种序列比对分析结果表明,尽管IDR的序列差异大,但是在各物种中的存在是保守的,表明相分离的能力在进化上可能是被正向选择的。
综上所述,该研究利用大规模、高通量的蛋白质组学技术,同时建立高通量的检验蛋白相分能力的体系,筛选和鉴定了8种植物的相分离蛋白组,为研究植物中生物大分子相分离的功能奠定基础。
该工作于2022年11月25日在《分子植物》(Molecular Plant)杂志上发表,题为“半体外大规模鉴定植物中具有相分离潜力的蛋白”(Large-scale identification of potential phase separation proteins from plants using a cell-free system)。
清华大学生命学院博士后张红红、科研助理彭方玉、2021级博士生何春以及博士后刘岩为本文共同第一作者,生命学院方晓峰助理教授和邓海腾教授为共同通讯作者。该工作得到了国家自然科学基金委和北京市自然科学基金委的经费支持。
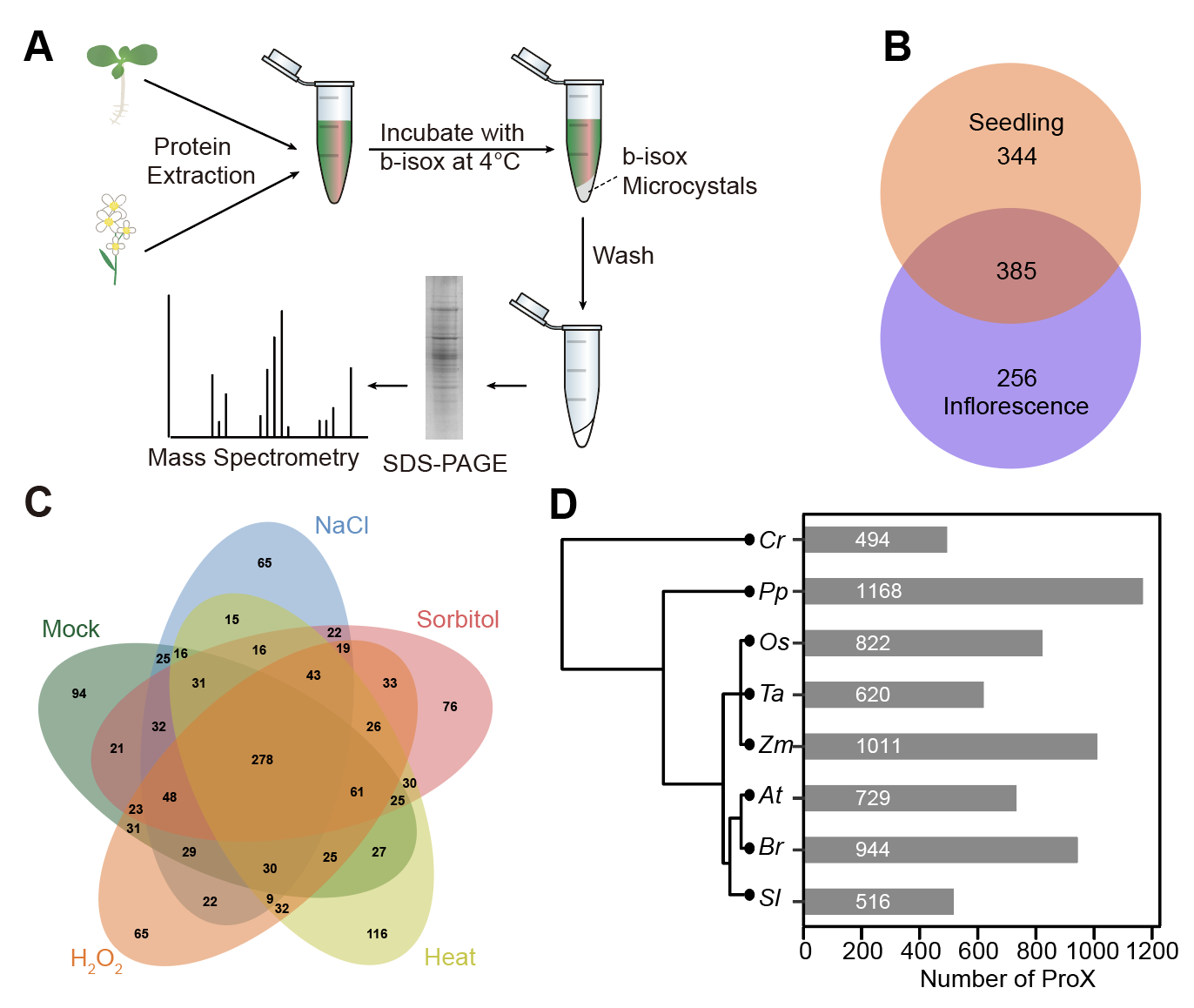
图1. (A)基于b-isox鉴定相分离蛋白的流程图。(B)韦恩图显示从拟南芥幼苗和花组织中鉴定到的具有相分离潜力的蛋白。(C)韦恩图显示从拟南芥在不同胁迫条件下鉴定到的具有相分离潜力的蛋白。(D)不同物种中鉴定得到的具有相分离潜力的蛋白的情况。Cr代表衣藻;Pp代表小立碗藓;Os代表水稻;Ta代表小麦;Zm代表玉米;At代表拟南芥;Br代表白菜;Sl代表番茄。